GSKとサノフィ、新型コロナウイルス感染症(COVID-19)に対するワクチンの承認取得に向けて前進
この資料は、仏サノフィおよび英国グラクソ・スミスクラインplcが2022年2月23日(英国現地時間)に発表したプレスリリースの日本語抄訳であり、報道関係者各位の利便性のために提供するものです。この資料の正式言語は英語であり、その内容およびその解釈については英語が優先されます。詳細はhttps://www.gsk.comをご参照ください。
<2022年2月23日、英国ロンドン発>
GSKとサノフィ、新型コロナウイルス感染症(COVID-19)に対するワクチンの承認取得に向けて前進
-
国際共同VAT02追加免疫(ブースター接種)試験の最終解析により、中和抗体価を18~30倍に増加させるという共通の効果をワクチンプラットフォーム全体(mRNA、アデノウイルス)で確認
-
VAT08第III相試験の初回接種において、血清陰性集団に対するサノフィ-GSKワクチンの2回接種により以下の点を示す:
-
COVID-19の重症化および入院の予防に対する100%の有効性
-
中等症または重症のCOVID-19の予防に対する75%の有効性
-
あらゆる症状を伴うCOVID-19の予防に対する有効性は57.9%であり、これは、懸念される変異株が優勢である現在の状況において期待されるワクチンの効果と一致
-
-
初回および追加接種(ブースター接種)後の安全性プロファイルは概ね良好
グラクソ・スミスクライン(本社:英国、以下GSK)とサノフィ(本社:フランス、以下サノフィ)は、2月23日、COVID-19ワクチンの規制当局への申請に基づき、追加免疫(ブースター接種)および第III相有効性試験のデータを提出する予定であることを発表しました。
冷蔵温度での安定性を有するアジュバント添加タンパク質ベースのサノフィ-GSKワクチンは、一貫して十分な免疫応答が誘導され、安全性プロファイルが概ね良好であることにより、公衆衛生上の意義は強く支持されています。承認済みのmRNAまたはアデノウイルスワクチンの初回接種を受けた参加者において、サノフィ-GSK追加接種(ブースター)ワクチンは、あらゆるワクチンプラットフォームおよび年齢層で中和抗体価を18~30倍とする有意な増加を誘導しました。サノフィ-GSKワクチンを初回接種(2回)とその後の追加接種(ブースター接種)として使用した場合、中和抗体価は追加接種(ブースター接種)前と比較して84~153倍に増加しました(詳細は図1aおよび1bを参照)。
サノフィ ワクチン部門グローバルヘッドのエグゼクティブ・バイス・プレジデントであるトマ・トリオンフ(Thomas Triomphe)は、次のように述べています。
「今回の私たちの科学力とCOVID-19ワクチンの有益性が確認できたデータについて、喜ばしく感じています。サノフィ-GSKのワクチンは、初回免疫に用いたワクチンの種類を問わず、全年齢層でブースター効果を発揮することが立証されました。現在の課題の多い疫学環境において初回免疫として接種する場合にも、有効性が認められました。オミクロン株をはじめとする懸念される変異株が多数流行しているこの時期に実施された第III相有効性国際共同試験は他にありません。今回得られた有効性データは、承認済みのワクチンの最近の臨床データと同様です。」
GSKグローバルワクチンのプレジデントであるロジャー・コナー(Roger Connor)は次のように述べています。
「COVID-19の疫学的拡大は、様々なワクチンの必要性を示しています。我々のアジュバント添加タンパク質ベースのワクチン候補は、パンデミックインフルエンザを含む他のウイルスへの感染予防に広く適用されている確立されたアプローチを用いています。我々は、このパンデミックへの対応を継続し、パンデミック後に備える上でも、このワクチンが重要な役割を果たすことができると確信しています。」
初回接種として2回接種した場合、サノフィ-GSKワクチンは十分な中和抗体を誘導し、幾何平均抗体価(GMT)は3711単位に達しました。既に承認され、有効なmRNAワクチンを2回接種した同じ年齢層の参加者の血清パネルと比較すると、同じ検査機関で同時に測定したGMTは1653単位でした。
VAT08有効性試験のデータから、血清陰性集団における、症状を伴うCOVID-19に対するサノフィ-GSKワクチンの2回接種による予防における有効性は57.9%(95%信頼区間[CI,26.5、76.7])であったことが示されました。また、サノフィ-GSKワクチンは、血清陰性集団において、重症のCOVID-19および入院に対して100%の予防効果(1回目接種後0例 対 10例、2回目接種後0例 対 4例)を示し、中等症から重症のCOVID-19に対しては75%の予防における有効性(3例 対 11例)を示しました。データ解析はまだ進行中ですが、初期のデータからは、デルタ株に起因する症状を伴うCOVID-19に対する予防の有効性は77%であり、期待されるワクチンの効果と一致していることが示されています。
両試験を通して、サノフィ-GSKワクチンは若年層と高齢者において、安全性および忍容性プロファイルは概ね良好でした。
両社は現在、米国食品医薬品局(FDA)や欧州医薬品庁(European Medicines Agency:EMA)などの規制当局と協議を進めており、規制当局の承認に向けて、このワクチン候補で得られたすべてのデータを提出する予定です。
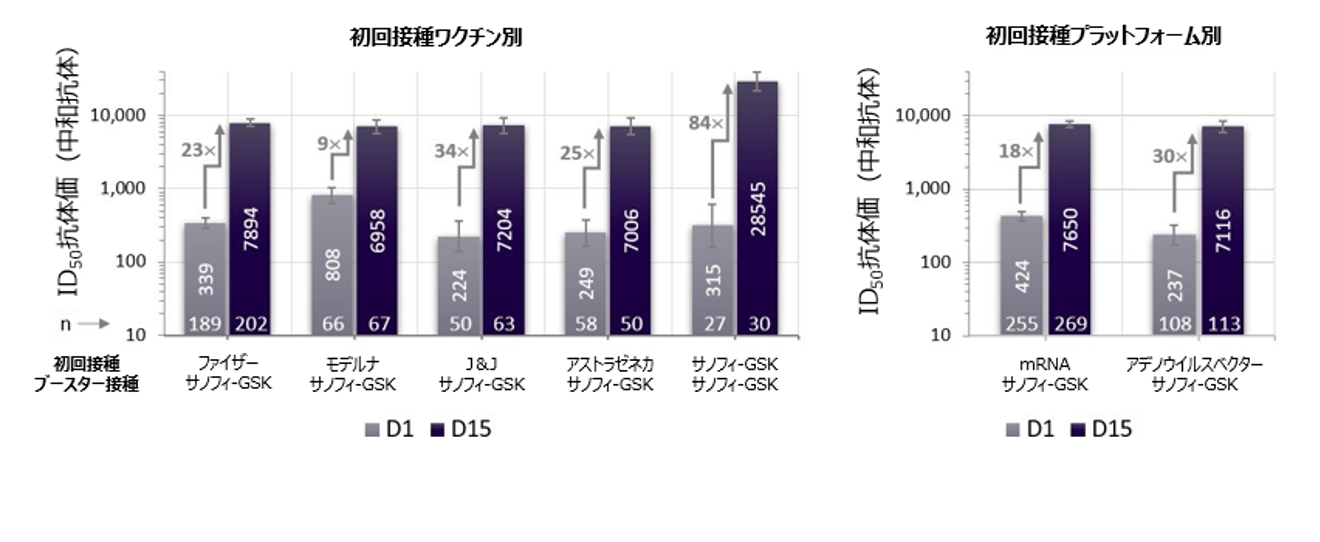
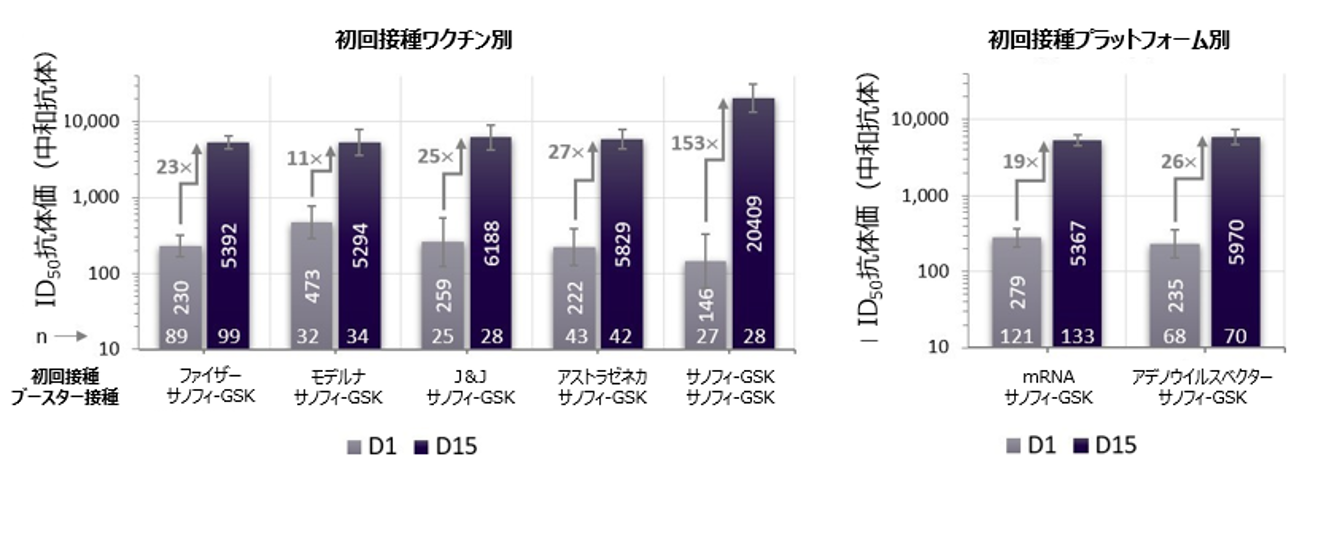
追加接種(ブースター接種)としての、サノフィ-GSKワクチンの免疫原性を評価するため、Monogram Biosciences[San Francisco、CA]にて、D614Gプロトタイプウイルスに対するFDA承認の標準化偽ウイルス中和試験(pVNT)を用いて、ヒト免疫血清サンプルの試験を実施しました。
VAT08およびVAT02について
第III相試験であるVAT08試験は、SARS-CoV-2アジュバント添加組換えタンパク質ベースワクチンの10µg抗原製剤の有効性、免疫原性および安全性をプラセボと比較して評価しています。
本VAT08試験の第1期では、18歳以上の10,000例以上を対象として、D614(親)ウイルスのスパイクタンパク質を含むワクチン製剤の有効性を評価しています。参加者は、米国、アジア、アフリカ、南米の各施設において、ワクチン10µgまたはプラセボを1日目と22日目に計2回接種する群のいずれかに無作為に割り付けられました。現在、B.1.351変異株(ベータ)のスパイクタンパク質を加えた第2の2価ワクチン製剤を評価する試験である第2期の患者組み入れ登録が完了しました。この第III相試験は、第II相試験(VAT02試験)の肯定的な初期結果を受けて行われました。VAT02試験では、成人722例にCOVID-19ワクチン候補を接種し、2回接種の安全性、反応原性、免疫原性を評価し、追加接種(ブースター接種)として使用するのに最適な用量を特定しました。その結果、全年齢層(18~95歳)、全用量で、2回接種後に、95~100%の抗体陽転を伴う高い中和抗体反応率が認められました。
VAT08およびVAT02両試験の詳細な結果は今年後半に公表される予定です。
これらの取り組みは、W15QKN-16-9-1002の契約の下、米国保健福祉省の事前準備・対応担当次官補局の一部門である米国生物医学先端研究開発局のフェデラルファンド、および、米国国防総省の化学・生物・放射性物質・核防衛統合計画事務局ならびに米国国立アレルギー感染症研究所(NIAID)の支援を受けています。NIAIDは、HIVワクチン試験ネットワーク(HVTN)リーダーシップ・オペレーションセンター(UM1AI68614HVTN)、統計・データ管理センター(UM1AI68635)、HVTN検査機関(UM1AI68618)、HIV予防試験ネットワークリーダーシップ・オペレーションセンター(UM1AI68619)、エイズ臨床試験グループリーダーシップ・オペレーションセンター(UM1AI68636)、感染症臨床研究コンソーシアム(UM1AI148684、UM1AI148450、UM1AI148372、UM1AI148574)に対して無償で資金の提供をしています。
GSKとサノフィの協働について
両社の協働において、サノフィは遺伝子組換え抗原を、GSKはアジュバントを提供しており、いずれもインフルエンザに対し効果が実証され、既に確立されたプラットフォームを使用しています。
GSKについて
GSKは、科学に根差したグローバルヘルスケアカンパニーです。詳細情報はhttps://jp.gsk.com/をご参照ください。
サノフィについて
サノフィは、人々の暮らしをより良くするため、科学のもたらす奇跡を追求する、というゆるぎない使命を原動力に進み続ける革新的でグローバルなヘルスケア企業です。約100ヵ国の社員は、医療を変革し、不可能を可能に変えるため、日々研鑽に努めています。私たちは、社会的責任と持続可能性を企業の本質とし、画期的な医薬品や生命を守るワクチンを開発し、世界何百万もの人々に届けていきます。
詳細は、http://www.sanofi.co.jpをご参照ください。